Chronisch-obstruktive Lungenkrankheit: drei neue Präparate
- Autor(en): Alexandra Röllin
- pharma-kritik-Jahrgang 37
, Nummer 6, PK965
Redaktionsschluss: 14. August 2015
DOI: https://doi.org/10.37667/pk.2015.965 - PDF-Download der Printversion dieser pharma-kritik Nummer
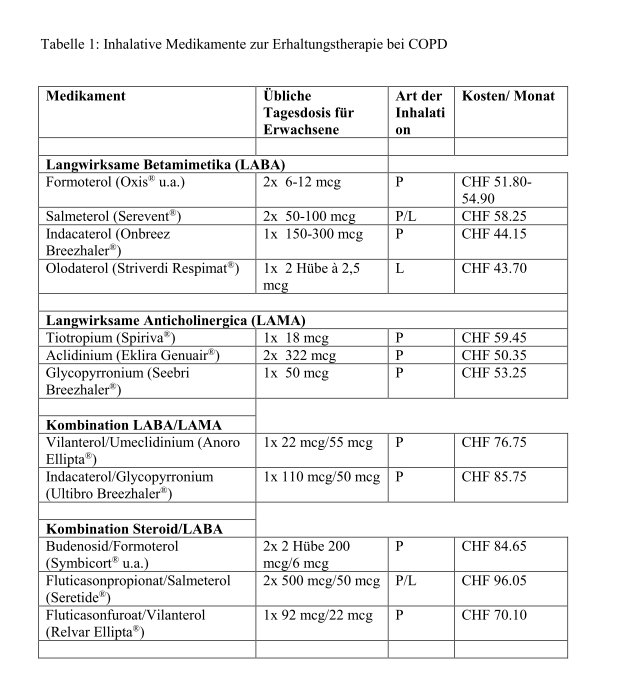
Im Verlauf des letzten Jahres sind mehrere neue Medikamente zur Erhaltungstherapie bei chronisch-obstruktiver Lungenkrankheit (COPD) auf den Markt gekommen. Drei dieser Präparate werden hier besprochen. Eine Tabelle, die einen Überblick über alle erhältlichen Präparate vermittelt, welche zur inhalativen Dauerbehandlung der COPD zugelassen sind, findet sich im Internet (Tabelle 1i).
Olodaterol
Olodaterol (Striverdi Respimat®) ist ein neues langwirksames Betamimetikum zur Dauerbehandlung bei COPD.
Chemie/Pharmakologie
Wie bei Indacaterol (Onbreez Breezhaler®) handelt es sich bei Olodaterol um einen selektiven, langwirksamen Beta-2-Agonisten (LABA), der über eine Stimulation der intrazellulären Adenylzyklase die Umwandlung von Adenosin-Triphosphat (ATP) zu zyklischem Andenosin-Monophosphat (cAMP) katalysiert und so die Relaxation der glatten Bronchialmuskulatur fördert.(1) Auch Olodaterol zeichnet sich durch eine bronchodilatierende Wirkung von mindestens 24 Stunden aus, so dass – im Gegensatz zu den beiden älteren LABA Formoterol (Foradil®, Oxis®) und Salmeterol (Serevent®) – nur einmal täglich inhaliert werden muss.(2)
Pharmakokinetik
Olodaterol wird über den sogenannten «Respimat Soft Mist Inhaler» verabreicht. Dieses neuartige Inhalationsgerät produziert aus einer wässerigen Medikamentenlösung ein sehr feines Aerosol, welches langsamer ausgestossen wird als bei einem konventionellen Dosieraerosol. Deshalb soll es auch ohne Vorschaltkammer eine einfachere Koordination mit der Einatmung und eine bessere Deposition in den unteren Atemwegen ermöglichen.(3,4)
Nach Inhalation von Olodaterol dauert es 10-20 Minuten, bis maximale Plasmaspiegel erreicht sind. Die systemische Verfügbarkeit nach Inhalation wird auf 30% geschätzt. Da sie bei oraler Verabreichung unter 1% beträgt, kann man annehmen, dass das Medikament hauptsächlich über die Lungen aufgenommen wird.
Der Abbau von Olodaterol erfolgt zu einem grossen Teil durch direkte Glukuronidierung und O-Demethylierung; dabei sind vor allem die Zytochrome CYP2C9 und CYP2C8, nicht aber CYP3A4 beteiligt. Ausgeschieden wird Olodaterol über Stuhl und Urin.
Klinische Studien
Die Wirksamkeit von Olodaterol wurde bei Personen über 40 Jahren mit einer mindestens mittelschweren COPD (FEV1<80% des Solls) und einer Raucher-Anamnese von mindestens zehn «pack years» geprüft. Rund drei Viertel der Untersuchten waren Männer. Bereits verwendete COPD-Medikamente (ausser anderen Beta-Agonisten) durften weiter eingenommen werden.
In je zwei identischen doppelblinden Crossover-Studien über viermal sechs Wochen wurde Olodaterol (1x 5 mcg oder 10 mcg täglich) mit Placebo und Formoterol (2x 12 mcg täglich) bzw. Tiotropium (1x 18 mcg täglich) verglichen. Die beiden Studien mit Formoterol umfassten insgesamt 199, diejenigen mit Tiotropium 230 Personen; primärer Endpunkt war das 24-h-Profil der forcierten Erstsekundenkapazität FEV1 (siehe Tabelle 2).(5,6) Über die gesamten 24 Stunden gemittelt betrachtet, schnitten alle aktiven Behandlungen besser ab als Placebo, unterschieden sich aber nicht signifikant voneinander. Für die ersten 12 Stunden galt dasselbe, während für die zweiten 12 Stunden Formoterol gegenüber Olodaterol geringgradig, aber doch statistisch signifikant besser abschnitt.
Mit Placebo wurde Olodaterol (1x 5 mcg täglich) in vier Doppelblindstudien über 48 Wochen bei insgesamt 3’104 COPD-Kranken verglichen.(7,8) Dabei galt der FEV1-Talwert («trough FEV1») als primärer Endpunkt. In Bezug darauf war Olodaterol Placebo nach 12 Wochen in 3 von 4 Studien überlegen und nach 24 Wochen in allen vier Studien. Diese Verbesserung konnte bis zum Studienende nach 48 Wochen beibehalten werden. Weder für die Exazerbationshäufigkeit noch für die subjektive Beeinträchtigung durch die Krankheitssymptome («Transition Dyspnea Index» TDI, siehe Tabelle 2) konnte ein Unterschied zwischen Placebo und Olodaterol gezeigt werden. Hinsichtlich Lebensqualität («St. George's Respiratory Questionnaire» SGRQ, siehe Tabelle 2) wurde mit Olodaterol gegenüber Placebo eine Verbesserung um 2,8 Punkte erreicht (statistisch signifikant, aber klinisch kaum relevant).
In zwei dieser vier Studien wurde Olodaterol zusätzlich mit Formoterol (2-mal täglich 12 mcg) verglichen, und war dabei der Behandlung mit Formoterol nicht überlegen. Ob Olodaterol zumindest gleichwertig zu Formoterol ist, kann nicht entschieden werden, da die Studien nicht zum Prüfen einer Nicht-Unterlegenheit ausgelegt waren.(8)
Mit Indacaterol und Vilanterol, den beiden anderen neuen LABA, wurde Olodaterol nicht direkt verglichen.
Unerwünschte Wirkungen
Folgende unerwünschte Wirkungen waren in klinischen Studien unter Olodaterol häufiger als unter Placebo: Infektionen der oberen Luftwege, Bronchitis, Harnwegsinfekte, Husten, Schwindel, Hautausschläge, Durchfall, Rücken- und Gelenkschmerzen. Mit den für Betamimetika typischen systemischen Nebenwirkungen wie Muskelzittern, Schlaflosigkeit, Herzklopfen, Tachykardien, verlängerte QT-Zeit, Hypokaliämie und Hyperglykämie ist auch nach Inhalation von Olodaterol zu rechnen. Allerdings wurde Olodaterol nicht an Personen mit schwerwiegenden kardialen Vorerkrankungen geprüft.(2)
Interaktionen
Obwohl Olodaterol über CYP2C9 und CYP2C8 abgebaut wird, scheint bei Kombination mit einem Hemmer/Induktor der entsprechenden Enzyme keine Dosisanpassung notwendig zu sein.
Hingegen besteht – wie bei allen Beta-2-Agonisten – in Kombination mit einem nicht-kaliumsparenden Diuretikum ein höheres Risiko für eine Hypokaliämie, welche ihrerseits kardiale Arrhythmien begünstigen kann. Zusammen mit anderen Medikamenten, welche zu einer Verlängerung der QT-Zeit führen können (wie z.B. selektive Serotoninwiederaufnahmehemmer, SSRI), nimmt das kardiovaskuläre Risiko ebenfalls zu.(3)
Dosierung und Verabreichung
Olodaterol (Striverdi Respimat®) ist als Inhalationslösung zur «symptomatischen Dauertherapie bei COPD» zugelassen und in der Schweiz kassenzulässig. Pro Hub aus dem «Respimat Soft Mist Inhaler» werden 2,5 mcg Olodaterol abgegeben. Die empfohlene Tagesdosis beträgt 5 mcg (zwei Sprühstösse einmal täglich). Vor dem ersten Gebrauch muss eine Patrone mit Lösungsmittel in den Inhalator eingesetzt werden (Anleitung in der Patienteninformation: http://goo.gl/iEPvSw). Nach Einsetzen einer neuen Patrone oder wenn der Inhalator für mehr als 21 Tage nicht verwendet wurde, muss dieser mit vier Sprühstössen in die Luft vorbereitet werden. Eine Dosisreduktion bei leichter bis mittelschwerer Nieren- oder Leberinsuffizienz ist nicht notwendig. Die Anwendung bei Kindern und während der Schwangerschaft und Stillzeit ist nicht untersucht.
Chemie/Pharmakologie
Indacaterol ist ein selektiver langwirksamer Beta-2-Agonist (LABA); Glycopyrronium gehört wie andere inhalative Anticholinergika zu den quaternären Ammoniumverbindungen und bindet sich kompetitiv an die fünf muskarinischen Rezeptortypen M1 bis M5. Am stärksten werden die M1- und M3-Rezeptoren blockiert, die beiden Rezeptoren, welche die Acetylcholin-bedingte Bronchokonstriktion vermitteln. Auch die Wirkung von Glycopyrronium hält bis zu 24 Stunden an, es gehört somit zu den langwirksamen Muskarin-Antagonisten (LAMA).
Da die bronchodilatierende Wirkung über zwei unterschiedliche Wirkmechanismen vermittelt wird, verspricht man sich von der Kombination der beiden Substanzen eine additive Wirkung.(1,9,10)
Pharmakokinetik
Für Glycopyrronium dauert es fünf und für Indacaterol 15 Minuten, bis nach der Inhalation maximale Plasmaspiegel erreicht sind. Die systemische Verfügbarkeit beträgt rund 45% für Indacaterol und 40% für Glycopyrronium. Von beiden Substanzen wird der Hauptanteil über die Lunge resorbiert und ein viel kleinerer Anteil über den Magendarmtrakt. Da Indacaterol in Kombination mit Glycopyrronium etwas stärker resorbiert wird als allein verabreicht, wurde die Dosis von 150 mcg im Einzelinhalator auf 110 mcg im Kombinationsprodukt angepasst, was zu vergleichbaren Plasmaspiegeln führen soll.
Glycopyrronium wird zu zwei Dritteln unverändert über die Nieren, Indacaterol dagegen hauptsächlich im Stuhl ausgeschieden. Dementsprechend wird die Elimination von Glycopyrronium bei Niereninsuffizienz verzögert. Die wichtigsten Abbauwege für Indacaterol sind die zytochromvermittelte Hydroxylierung (CYP3A4) sowie die direkte Glukuronidierung. Bei leichter bis mässiggradiger Leberfunktionsstörung fand sich allerdings keine Veränderung der durchschnittlichen Plasmaspiegel.(1,9,10)
Klinische Studien
Die Kombination Indacaterol/Glycopyrronium wurde bei COPD-Kranken (mehr Männer als Frauen) ab 40 Jahren mit einem mittelschweren bis schweren Krankheitsstadium (GOLD-Stadien II-III) in mehreren randomisierten Studien untersucht. Hier die drei Studien mit den wichtigsten Ergebnissen:
In der SHINE-Studie (2’144 Untersuchte) wurde die Fixkombination über 26 Wochen doppelblind sowohl mit Placebo, als auch mit den beiden Einzelkomponenten verglichen.(11) Der FEV1-Talwert nach 26 Wochen (primärer Endpunkt) betrug 1,45 l für die Kombination, 1,25 l für Placebo, 1,38 l für Indacaterol und 1,36 l für Glycopyrronium allein. Der Unterschied zwischen der Kombination und den beiden Einzelsubstanzen war damit zwar statistisch signifikant, blieb aber unter dem Wert, der als klinisch relevant betrachtet wird (100 ml).
In der SPARK-Studie wurde über 64 Wochen Indacaterol/Glycopyrronium doppelblind mit Glycopyrronium allein verglichen.(12) Die 2’224 untersuchten Personen litten an einer schweren bis sehr schweren COPD (GOLD III-IV), primärer Endpunkt war die Häufigkeit mittelschwerer bis schwerer Exazerbationen im ganzen Behandlungszeitraum. Dabei traten unter der Kombinationsbehandlung 0,84 und unter der alleinigen Behandlung mit Glycopyrronium 0,95 Exazerbationen pro Jahr auf, was einer absoluten Differenz von 0,11 Exazerbationen pro Jahr entspricht.
Sowohl in der SHINE- als auch in der SPARK-Studie lief ein nicht-verblindeter Arm mit Tiotropium (Spiriva®, 1-mal täglich 18 mcg) mit. Die FEV1-Werte in der SHINE-Studie für Tiotropium bewegten sich dabei in einem ähnlichen Bereich wie diejenigen für die Einzelsubstanzen, währenddem in der SPARK-Studie kein Unterschied zwischen Indacaterol/Glycopyrronium und Tiotropium gezeigt werden konnte.(3,4,5)
In der QUANTIFY-Studie wurde Indacaterol/Glycopyrronium bei 934 Personen über 26 Wochen doppelblind mit der freien Kombination von Formoterol (2-mal täglich 12 mcg) und Tiotropium (1-mal täglich 18 mcg) verglichen.(13) Als primärer Endpunkt galt die Lebensqualität (SGQR). Diesbezüglich war die Kombination Indacaterol/Glycopyrronium zwar der freien Kombination Formoterol/Tiotropium nicht unterlegen, jedoch auch nicht überlegen. Unter Indacaterol/Glycopyrronium waren kardiale unerwünschte Wirkungen (nicht-signifikant) numerisch häufiger.
Unerwünschte Wirkungen
Unerwünschte Wirkungen unmittelbar nach Inhalation wie Husten, Nasopharygitis und/oder Mundtrockenheit treten bei rund einem Drittel der Behandelten auf. Kardiovaskuläre Ereignisse wie das Auftreten eines Vorhofflimmerns oder eines atrioventrikulären Blocks sowie ein Pulsanstieg und eine Verlängerung der QT-Zeit waren im Vergleich zu Placebo leicht erhöht. Auch Kopfschmerzen, Rückenschmerzen, Urininfekt, gastroösophagealer Reflux, Pneumonie sowie Infekte des oberen sowie unteren Respirationstraktes traten häufiger auf als unter Placebo.(10) Seit Glycopyrronium als Einzelsubstanz zugelassen ist, traten im Zusammenhang damit zwölf Fälle von akutem Angioödem auf.(14)
Interaktionen
Da sowohl Glycopyrronium als auch Indacaterol nur in geringer Menge systemisch verfügbar ist, sind pharmakokinetische Interaktionen von untergeordneter Bedeutung. Eher ins Gewicht fallen pharmakodynamische Interaktionen bei Kombination mit Substanzen, welche die gleichen Rezeptoren beeinflussen (andere Betamimetika, Betablocker oder Anticholinergika).(1,9,10)
Dosierung und Verabreichung
Die fixe Kombination Indacaterol/Glycopyrronium (Ultibro Breezhaler®) ist als Hartkapsel im Handel, welche 110 mcg Indacaterol und 50 mcg Glycopyrronium in Pulverform enthält. Das Präparat ist in der Schweiz kassenzulässig. Offizielle Indikation ist die «bronchienerweiternde Erhaltungstherapie bei symptomatischen Personen mit COPD, bei welchen eine tief dosierte LAMA- oder LABA-Monobehandlung allein nicht genügend wirksam ist». Täglich soll einmal eine Kapsel (110/50 mcg) inhaliert werden. Die Kapseln müssen zur Inhalation in ein spezielles, mitgeliefertes Inhalationsgerät, den «Breezhaler» eingelegt werden, was eine gewisse Geschicklichkeit erfordert.
Bei Kindern sowie schwangeren oder stillenden Frauen wurde das Medikament nicht geprüft.
Umeclidinium/Vilanterol-Kombinationspräparat
Seit Juli 2014 ist ferner mit Umeclidinium/Vilanterol (Anoro Ellipta®) eine zweite fixe Kombination von einem LAMA und einem LABA zugelassen. Bei diesem Präparat wird – im Unterschied zu anderen Kombinationen – das LAMA vor dem LABA genannt. Im Gegensatz zu Indacaterol und Glycopyrronium sind Vilanterol und Umeclidinium (Incruse Elipta®) aktuell nicht als Einzelsubstanzen im Handel.
Chemie/Pharmakologie
Die Struktur von Umeclidinium zeigt gewisse Ähnlichkeiten mit Glycopyrronium; die Vilanterol-Struktur ist sehr ähnlich wie diejenige von Salmeterol. Auch hier wird ein selektiver, langwirksamer Beta-2-Agonist (LABA) mit einem langwirksamen Muskarin-Antagonisten (LAMA) kombiniert, wovon man sich eine additive Wirkung verspricht. Aufgrund der langen Halbwertszeiten muss auch diese Kombination nur einmal täglich inhaliert werden.
Pharmakokinetik
Beide Substanzen werden etwa 5-15 Minuten nach Inhalation systemisch verfügbar, die absolute Bioverfügbarkeit beträgt dabei rund 13% für Umeclidinium und 27% für Vilanterol, die orale Resorption ist bei beiden vernachlässigbar.
Beide Substanzen sind Substrate von P-Glykoprotein. Umeclidinium wird primär über CYP2D6, Vilanterol primär über CYP3A4 metabolisiert. Umeclidinium wird vorwiegend (>90%) mit dem Stuhl, Vilanterol zu 70% mit dem Urin und zu 30% mit dem Stuhl ausgeschieden.(15)
Klinische Studien
Auch Umeclidinium/Vilanterol wurde nur bei COPD-Kranken mit aktuellem oder früherem Nikotinabusus geprüft. In zwei Doppelblindstudien (bei 3’029 Personen) wurde über 24 Wochen die Kombination Umeclidinium/Vilanterol (55/22 mcg) mit Placebo und den entsprechenden Einzelsubstanzen verglichen.(15,16) Dabei war bezüglich des FEV1-Talwerts (primärer Endpunkt) die Kombination sowohl Placebo als auch den Einzelsubstanzen überlegen, wobei aber nur die Unterschiede gegenüber Placebo als klinisch relevant eingestuft wurden.
Mit Tiotropium als Standardtherapie wurde Umeclidinium/Vilanterol in drei verschiedenen Studien mit unterschiedlichem Design verglichen.(17,18) Die beteiligten Personen litten an einer mindestens mittelschweren COPD. Dabei kam Umeclidinum/Vilanterol unter anderem auch in der aktuell zugelassenen Dosis (55/22 mcg 1x täglich) zum Einsatz: diese Dosierung wurde insgesamt bei 878 Personen, Tiotropium (18 mcg 1x täglich) bei 869 verabreicht. Gleichzeitig war die Anwendung von inhalativen Glukokortikoiden und anderen COPD-Basismedikamenten erlaubt. Auch hier war der primäre Endpunkt der FEV1-Talwert nach 24 Wochen. Der Unterschied gegenüber Tiotropium war zwar in allen drei Studien statistisch signifikant, erreichte aber nur in einer davon ein als klinisch relevant geltendes Mass (112 ml, in den anderen beiden Studien 90 bzw.60 ml). Als sekundärer Endpunkt wurde die krankheitsspezifische Lebensqualität (SGRQ) gemessen. Diese fand sich nur in einer der drei Studien unter der Kombinationstherapie marginal (um 2,1 Punkte) besser als unter Tiotropium.
Während für Tiotropium ein positiver Einfluss auf die Exazerbationshäufigkeit belegt ist, ist dies für die Kombination Umeclidinium/Vilanterol nicht der Fall.(19) Im Vergleich mit Tiotropium war die Exazerbationshäufigkeit in einer der Studien um 50% reduziert und in den anderen beiden um 20% bzw. 90% erhöht – keine der drei Studien war allerdings für diesen Endpunkt ausgelegt.(15,17,18)
Unerwünschte Wirkungen
Bei mehr als 1% der Behandelten und häufiger als unter Placebo traten die folgenden unerwünschten Wirkungen auf: Husten, Pharyngitis, Infektionen der oberen Luftwege, Sinusitis, Rachenschmerzen, trockener Mund, Harnwegsinfekte, Kopfschmerzen und Verstopfung. Unerwünschte kardiale Wirkungen wie Vorhofflimmern, supraventrikuläre Tachykardien und andere waren ebenfalls häufiger als unter Placebo, aber seltener als in 1%. Ebenso wie bei anderen Kombinationen eines LABA mit einem LAMA ist eine additive kardiale Toxizität der beiden Komponenten nicht auszuschliessen.(15)
Interaktionen
Da Vilanterol ein Substrat von CYP3A4 und P-Glykoprotein ist, kann ein starker Hemmer beider Enzyme wie beispielsweise Clarithromycin (Klacid® u.a) zu einem Anstieg der Plasmaspiegel und somit zu vermehrten systemischen Nebenwirkungen führen. Wie bei allen anderen LABA und LAMA dürfen mögliche pharmakodynamische Interaktionen mit anderen Betamimetika, Betablockern oder Anticholinergika nicht vergessen werden.
Dosierung und Verabreichung
Die Kombination Umeclidinium/Vilanterol (Anoro Ellipta®) ist zur Erhaltungstherapie der COPD bei ungenügendem Ansprechen auf eine Monotherapie zugelassen. Das Präparat ist in der Schweiz kassenzulässig. Täglich soll einmal inhaliert werden, wobei 55 mcg Umeclidinium und 22 mcg Vilanterol in Pulverform freigesetzt werden. Es müssen weder Kapseln noch Patronen mit Inhalationslösung in den Inhalator eingelegt werden, was die Handhabung vereinfacht.
Das Präparat ist weder bei Kindern noch bei schwangeren oder stillenden Frauen geprüft worden.
Kommentar
In letzter Zeit sind so viele neue Substanzen zur Erhaltungstherapie der COPD auf den Markt gekommen, dass man den Eindruck gewinnt, es hätte sich auf diesem Gebiet unglaublich viel getan. Doch betrachtet man die Daten etwas genauer, findet man einzig eine enttäuschende Reihe sogenannter «me-too»-Medikamente, bei denen zwar eine Überlegenheit gegenüber Placebo, nicht aber gegenüber vergleichbaren Wirksubstanzen dokumentiert ist. Auch der gegenüber der Monotherapie zusätzliche Nutzen der neu verfügbaren fixen LABA/LAMA-Kombinationen überzeugt nicht generell.
Sicher gibt es die schwerkranken COPD-Kranken, die unter Behandlung mit einer Einzelsubstanz immer noch stark beeinträchtigende Symptome zeigen und von einer Kombinationstherapie profitieren. Die fix verfügbaren Kombinationen vereinfachen in solchen Fällen zwar die Behandlung. Doch vermutlich werden sie (und das entsprechende Marketing der Herstellerfirmen) auch dazu verleiten, Betroffene, welche bereits mit einer Monotherapie beschwerdefrei wären, unnötigerweise mit der Kombination zu behandeln und so ohne jeglichen Zusatznutzen ein kumuliertes Risiko für Nebenwirkungen und höhere Kosten in Kauf zu nehmen. Viel zu oft geht nämlich vergessen, dass es sich bei der Inhalationsbehandlung der COPD um eine symptomatische Therapie handelt, die keinen Einfluss auf das Fortschreiten der Krankheit hat.
Aufgrund der Kontroverse um den Einsatz langwirksamer Betamimetika bei Asthma sind alle drei vorgestellten Medikamente für den Einsatz bei Asthma weder dokumentiert noch zugelassen. Deshalb sollten sie dafür nicht verwendet werden, auch wenn aufgrund ihres Wirkmechanismus eine positive Wirkung durchaus möglich ist.
Literatur
- 1) Masche UP. pharma-kritik 2010; 32: 33-4
- 2) FDA Center for Drug Evaluation and Research Summary Review: http://goo.gl/GKm8pf
- 3) Anon. Drug Ther Bull 2015; 53: 42-5
- 4) Yawn BP et al. Int J Chron Obstruct Pulmon Dis 2012; 7: 495-502
- 5) Feldman GJ et al. Springer Plus 2014; 3: 419
- 6) Lange P et al. J Pulm Respir Med 2014; 4: 196
- 7) Ferguson GT et al. Int J Chron Obstruct Pulmon Dis 2014; 9: 629-45
- 8) Koch A et al. Int J Chron Obstruct Pulmon Dis 2014; 9: 697-714
- 9) Masche UP. pharma-kritik 2013; 35: 43-4
- 10) EMA Assessment Report: http://goo.gl/fk0nZb
- 11) Bateman ED et al. Eur Respir J 2013; 42: 1484-94
- 12) Wedzicha JA et al. Lancet Respir Med 2013; 1: 199-209
- 13) Buhl R et al. Thorax 2015; 70: 311-9
- 14) EMA „Pharmacovigilance Risk Assessment Committee (PRAC). Minutes of the meeting on 4-7 november 2013“ 4. Dezember 2013: 57 pages: http://goo.gl/tUcvY8
- 15) EMA Assessment Report: http://goo.gl/kNP2Ll
- 16) Donohue JF et al. Respir Med 2013; 107: 1538-46
- 17) Decramer M et al. Lancet Respir Med 2014; 2: 472-86
- 18) Maleki-Yazdi MR et al. Respir Med 2014; 108: 1752-60
- 19) Karner C et al. Cochrane Database Syst Rev 2014; 7: CD009285
- 20) Cazzola M et al. Eur Respir J 2008; 31: 416-69
- 21) Mahler DA et al. COPD 2005; 2: 99-103
Standpunkte und Meinungen
- Datum des Beitrags: 8. September 2015 (12:00:16)
- Verfasst von: Prof.Dr. Robert Thurnheer, Chefarzt / Kantonsspital (Münsterlingen)
- Duale Bronchodilatation
Herzlichen Glückwunsch zu Ihrem Artikel betr den neuen Inhalativa zur COPD-Therapie und besten Dank für diese hilfreiche und übersichtliche Zusammenfassung. Das meiste würde ich ähnlich beurteilen, in einem Punkt aber vermute ich aber einen anderen Grund für den Einsatz der dualen Bronchodilatation: Ich denke nicht, dass viele Patienten mit einem langwirksamen Bronchodilatator symptomfrei wären und dann übertherapiert würden; gemäss der klinischen Erfahrung und auch vieler Untersuchungen sind fast alle COPD-Patienten, zumindest ab Stadium 2 auch mit zwei Bronchodilatatoren noch symptomatisch. Aber es wird wohl eher so sein, dass viele behandelnde Aerzte bereits mit einer Zweier-Kombi beginnen werden obwohl die Zulassung anders lautet, dies weil man bei starken Symptomen die möglichst starke Therapie geben möchte. Ob dies einer Ueberbehandlung enspricht, wird sich am Verhältnis Nutzen/NW zeigen. Die NW und besonders die Interaktionen (derer ich mir gar nicht so bewusst war) sind offenbar nicht zu unterschätzen.
Copyright © 2024 Infomed-Verlags-AG
PK965
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.