Medikamentöse Therapie des Mammakarzinoms
- Autor(en): Brigitte Brand, Rudolf A. Joss
- Reviewer: Carlo Calanchini
- pharma-kritik-Jahrgang 11
, Nummer 04, PK613
Redaktionsschluss: 28. Februar 1989 - PDF-Download der Printversion dieser pharma-kritik Nummer
Übersicht
Unter dem Begriff des Mammakarzinoms wird eine heterogene Gruppe von Tumoren der weiblichen Brustdrüse mit sehr unterschiedlichem Verlauf und Prognose zusammengefasst. Mammakarzinome werden in der Regel in einem scheinbar lokalisierten Stadium diagnostiziert. Trotzdem kann der natürliche Verlauf der Krankheit durch rein lokale Massnahmen nur bei einem kleineren Teil der Frauen aufgehalten werden. Grund für das Ungenügen rein lokaler Behandlungen ist die Tatsache, dass beim Mammakarzinom sehr häufig bereits bei der Diagnose Mikro- oder sogar Makrometastasen vorliegen und eine optimale Behandlung des Tumors somit den Einsatz einer systemischen Therapie bedingt.
Das Mammakarzinom präsentiert sich dem Arzt in vier verschiedenen Erscheinungsformen (siehe Tabelle 1). Die folgenden Ausführungen beschränken sich auf die medikamentöse Therapie des primär operablen Mammakarzinoms (also die Behandlung von Mikrometastasen) und die Systemtherapie des metastasierenden Mammakarzinoms (also die Behandlung von Makrometastasen). Eine solche Therapie sollte stets mit einem erfahrenen Spezialisten geplant und durchgeführt werden. Nur so besteht Gewähr dafür, dass die Behandlung dem Einzelfall angepasst wird und dass bei der Durchführung keine wichtigen Einzelheiten (Dokumentation, Dosisanpassungen, drohende Komplikationen, Zeitpunkt des Therapiewechsels bei Tumorprogredienz usw.) übersehen werden.
Adjuvante Therapien nach Operation eines Mamma - karzinoms
Trotz der scheinbar lokalisierten Krankheit hat das operable Mammakarzinom oft eine düstere Langzeitprognose wegen der bei der Diagnose meistens bereits vorhandenen, mit unseren heutigen Methoden aber nicht fassbaren Mikrometastasen. In den letzten Jahren ist es deshalb zu zwei unterschiedlichen Entwicklungen in der Therapie gekommen:
1. In der Chirurgie fand eine Abkehr von der radikalen Mastektomie nach Halsted statt. Heute gilt die modifizierte radikale Mastektomie mit Axillaausräumung als Standardoperation. Sie ist kosmetisch weniger entstellend, beeinträchtigt aber die Überlebenschancen nicht. Eine weitere Einschränkung des chirurgischen Eingriffs ist in ausgewählten Fällen statthaft, nämlich dann, wenn der Tumor unter 2 (bis 3) cm Durchmesser gross ist -- entsprechend einem T1-(oder T2-)Tumor -- und die nachfolgende, obligate Strahlentherapie von der Brustkonfiguration her möglich ist. Dieses Vorgehen bedingt eine enge interdisziplinäre Zusammenarbeit zwischen dem Operateur, dem Strahlentherapeuten, dem medizinischen Onkologen und dem Pathologen.
2. Die Erkenntnis, dass das Mammakarzinom bereits bei der Diagnose häufig eine Systemkrankheit ist, führte konsequenterweise zur medikamentösen Nachbehandlung der operierten Patientinnen, also zur adjuvanten Hormonoder Chemotherapie.
Die adjuvante Therapie des Mammakarzinoms ist Gegenstand zahlreicher Publikationen der letzten Jahre. Einzelne Aspekte können heute als gesichert gelten; es kommen aber laufend neue Erkenntnisse hinzu.
Patientinnen, bei denen die Operation einen Befall deraxillären Lymphknoten ergeben hat, weisen ein hohes Risiko auf, dass im weiteren Krankheitsverlauf Metastasen klinisch manifest werden. Für diese Gruppe von Patientinnen wird heute nicht mehr am Nutzen einer adjuvanten Therapie gezweifelt. Bei diesen Frauen ist also eine systemische Nachbehandlung grundsätzlich angezeigt; je nachdem, ob eine Patientin vor oder nach der Menopause erkrankt und entsprechend dem Rezeptorstatus wird eine Chemotherapie oder eine Hormontherapie empfohlen (vgl. Tabelle 2).(1)
Die Resultate der adjuvanten Therapien bei nodal positiven Patientinnen lassen sich folgendermassen zusammenfassen:
-- Rezidivfreie und Gesamtüberlebenszeit werden nach 10 Jahren um etwa 15% verbessert;(2,3) in einzelnen Untergruppen sind noch wesentlich grössere Differenzen feststellbar.
-- Kombinationschemotherapien sind den Monotherapien überlegen
-- Relativ kurzfristige Chemotherapien (6 Monate) sind gleich wirksam wie längerfristige Chemotherapien
-- Bei der adjuvanten Chemotherapie besteht eine steile Dosis-Wirkungskurve, weshalb keine unnötigen Dosis- Reduktionen vorgenommen werden sollten
-- Bei rezeptorpositiven Mammakarzinomen ist die adjuvante Hormontherapie sicher wirksam.
Schwieriger ist die Indikationsstellung beim operierten Mammakarzinom ohne axillären Lymphknotenbefall. Patientinnen mit nodal negativem Karzinom stellen eine heterogene Gruppe mit teils niedrigem, teils hohem Rezidivrisiko dar. Heute wird versucht, dieses Risiko bei jeder einzelnen Patientin anhand von prognostischen Kriterien abzuschätzen. Die wichtigsten dieser Kriterien sind in Tabelle 3 zusammengestellt. Weitere Kriterien (Proliferationsindex, Onkogen-Amplifikation) eignen sich vorläufig nicht für die Praxis.
Vorläufige Resultate von neuen Studien bei nodal negativen Patientinnen sind ermutigend:
-- Bei Karzinomen mit (vergleichsweise) ungünstiger Prognose (rezeptornegative Tumoren oder Primärtumoren mit einem Durchmesser von mindestens 3 cm) haben verschiedene Chemotherapien nach 4 Jahren bei den behandelten Frauen eine um rund 10% erhöhte Rezidivfreiheit ergeben.(4,5)
-- Sogar ein einmaliger Chemotherapiezyklus in den ersten Stunden nach der Operation hat die Prognose der behandelten Frauen (vor oder nach der Menopause, mit rezeptornegativen oder -positiven Tumoren) verbessert. (6)
-- Frauen mit günstiger Prognose (d.h. rezeptorpositivem Tumor), die eine adjuvante Hormontherapie erhalten, sind nach 4 Jahren noch zu 83% rezidivfrei, ohne Therapie nur zu 77%.(7)
Als adjuvante Hormontherapie wird Tamoxifen (Nolvadex®, Kessar®) eingesetzt. Die Behandlung mit täglich 20 mg Tamoxifen per os wird während fünf Jahren kontinuierlich fortgesetzt, sofern nicht ein Rezidiv auftritt.
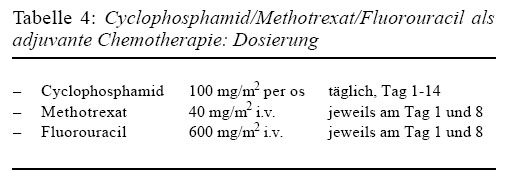
Als adjuvante Chemotherapie hat sich die CMF-Kombination -- Cyclophosphamid (Endoxan®, Cyclostin®), Methotrexat und Fluorouracil (Fluorouracil Roche®, Fluroblastin®) -- bewährt. Für diese Behandlung wird eine normale Funktion von Knochenmark, Leber und Niere vorausgesetzt. Die adjuvante Chemotherapie soll spätestens 4 Wochen nach der Operation beginnen. Die übliche Dosierung der Medikamente findet sich in Tabelle 4. Auf einen Therapiezyklus von 2 Wochen folgt jeweils eine Pause von 2 Wochen, dann beginnt ein neuer Therapiezyklus.
Im Gegensatz zu Tamoxifen, welches fast immer gut vertragen wird, verursacht die Chemotherapie mit CMF in der Regel deutlich mehr Nebenwirkungen. Nebst der bewusst in Kauf genommenen Myelosuppression sind vor allem Übelkeit und Erbrechen für die Patientinnen belastend und werden nicht selten dosislimitierend.(5) Es ist deshalb verständlich, dass nach weniger toxischen Chemotherapie- Kombinationen gesucht wird und dass einzelne Experten den Nutzen der Chemotherapie bei nodal negativen Patientinnen auch heute noch sehr zurückhaltend beurteilen.(8) Jedenfalls müssen die Zytostatikadosen bei entsprechender Toxizität in üblicher Weise reduziert werden. Es ist anderseits wichtig, dass keine unnötigen Dosisreduktionen vorgenommen werden, weil diese den Therapieerfolg gefährden oder gar zunichte machen können. Zusammenfassend lässt sich sagen, dass heute eine Nachbehandlung der grossen Mehrzahl der Patientinnen mit operablem Mammakarzinom gerechtfertigt ist. Eine Behandlung im Rahmen einer der laufenden Studien sichert einer Patientin eine anerkannt wirksame Behandlung zu und erlaubt eine kritische Überprüfung der Behandlungsergebnisse, aber auch der langfristigen Nebenwirkungen.
Das metastasierende Mammakarzinom
Sind einmal Fernmetastasen manifest, so muss das Mammakarzinom als unheilbare Krankheit angesehen werden. Mit der Hormon- und Chemotherapie stehen aber wirksame Systemtherapien zur Verfügung, mit denen sogar komplette Remissionen erreicht werden können.
Grundsätzlich ist bei gesicherten Fernmetastasen die Indikation zur Einleitung einer systemischen Behandlung gegeben. Lediglich eine isolierte Haut-, Lymphknotenoder Skelettmetastase kann unter Umständen mit einer ausschliesslich lokalen (chirurgischen oder radiologischen) Behandlung angegangen werden. Vor Beginn einer Systemtherapie sollte eine Krankheitsbilanz erstellt werden. Ausserordentlich wichtig ist, dass der Therapieerfolg anhand eines messbaren Tumorparameters dokumentiert wird. Im allgemeinen soll eine Systemtherapie konsequent und in optimaler Dosierung bis zur dokumentierten Tumorprogression fortgeführt werden.
Im Gegensatz zur adjuvanten Therapie nach der Operation, bei welcher eine Heilung erhofft wird, ist die medikamentöse Therapie des metastasierenden Mammakarzinoms immer nur palliativ. In diesem Zusammenhang gewinnen unerwünschte Wirkungen der Behandlung eine grosse Bedeutung. Es gilt deshalb, nicht nur eine objektive Tumorregression zu erreichen (welche in der Regel mit einer Besserung der klinischen Symptomatik einhergeht), sondern auch der Patientin eine den Umständen entsprechend optimale Lebensqualität zu sichern.(9)
Intensive Therapien mit ausgeprägteren Nebenwirkungen sollten den prognostisch ungünstigen Situationen vorbehalten bleiben (hormonell ausbehandelte oder Hormonrezeptoren- negative Mammakarzinome mit kurzem rezidivfreiem Intervall und multiplen metastatisch befallenen Organsystemen bzw. viszeralen Metastasen und/oder Resistenz auf primäre, «milde» Chemotherapie).
Hormontherapie
Mit endokrinen Therapien kann bei etwa 25 bis 30% der Patientinnen eine Remission erzielt werden, die im Durchschnitt 12 Monate anhält. Bei rezeptorpositiven Tumoren beträgt die Remissionsrate sogar 50 bis 60%.
Vor der Menopause gilt nach wie vor die Ovarektomie als erste Massnahme. Als mögliche Alternative empfehlen heute einzelne Autoren, primär Tamoxifen zu geben.(10)
Nach der Menopause soll auf alle Fälle zuerst Tamoxifen (20 mg/Tag) versucht werden. Tamoxifen ist im allgemeinen gut verträglich, kann aber einmal eine Hyperkalzämie hervorrufen.
Führt die primäre Hormontherapie nicht zum Erfolg, so wird auf eine Chemotherapie gewechselt. Ist die primäre Hormontherapie aber zunächst erfolgreich, so soll später bei erneuter Tumorprogression eine zweite und noch später eventuell auch eine dritte Hormontherapie versucht werden. Vor der Menopause nennen die meisten Autoren Tamoxifen als Sekundärtherapie nach Ovarektomie. Nach der Menopause kommen Aminoglutethimid (Orimeten®) oder Gestagene als Sekundärtherapien in Frage.
Aminoglutethimid kann initial eine starke Müdigkeit verursachen und soll deshalb in langsam einschleichender Dosierung (bis zum Erreichen einer Tagesdosis von 500 mg/Tag) gegeben werden.(11) Aminoglutethimid hemmt die Steroidsynthese in der Nebennierenrinde und erfordert deshalb die gleichzeitige Verabreichung von Kortikosteroiden (z.B. Hydrocortison 30 mg/Tag). Dieses Medikament kann auch ein (transitorisches) Exanthem und -- seltener -- eine Leukopenie oder eine Thrombopenie verursachen.
Als Gestagene werden Megestrolacetat (Megace®, täglich 160 mg per os) oder Medroxyprogesteronacetat (Depo-Provera ®, Farlutal®, initial während 4 Wochen 500 bis 1000 mg/Tag, später noch 2mal wöchentlich 500 mg) verwendet. Die parenterale Verabreichung von Medroxyprogesteronacetat ist nach neueren Untersuchungen nicht notwendig, das Medikament wirkt oral ebenso gut.(12) Gestagene verursachen vergleichsweise mehr Nebenwirkungen (Gewichtszunahme, Hypertonie, Ödeme, Hitzewallungen, diabetogene Wirkung) und stellen daher für viele Autoren die letzte Wahl unter den Hormontherapien dar.(13)
Chemotherapie
In verschiedenen Untersuchungen ist gezeigt worden, dass die Kombination mehrerer Zytostatika der Monotherapie sowohl bezüglich Remissionsrate wie auch Remissionsdauer und Gesamtüberlebenszeit überlegen ist.(14) Die wichtigsten Kombinationschemotherapien sind einerseits Variationen des 1969 von Richard Cooper erstmals beschriebenen CMFVP-Therapieschemas mit Cyclophosphamid, Methotrexat, Fluorouracil, Vincristin und Prednison,(15) anderseits die auf Doxorubicin (Adriamycin, Adriblastin®) basierenden Chemotherapien. Mit diesen Kombinationen wird bei 50 bis 70% der Patientinnen eine Remission erzielt, die im Mittel über 8 bis 10 Monate anhält. Die von Cooper verwendete CMFVP-Kombination wird heute von vielen Onkologen als vergleichsweise intensiv und nebenwirkungsreich angesehen. In den beiden letzten Jahrzehnten sind viele Variationen des Cooper- Schemas geprüft worden. Keine dieser anderen Kombinationen ist dem ursprünglichen CMFVP-Schema hinsichtlich Remissionsrate und Remissionsdauer eindeutig unter- oder überlegen.(13)
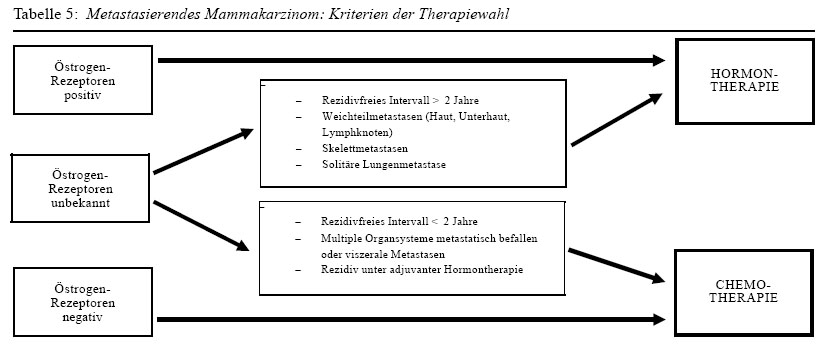
Daraus ergibt sich, dass bei der Therapiewahl -- neben den prognostischen Faktoren (siehe Tabelle 5) -- auch die Verträglichkeit der gewählten Zytostatika berücksichtigt werden soll. Subjektiv stehen dabei Magen-Darm-Probleme (Brechreiz, Erbrechen, Durchfall) und der Haarausfall im Vordergrund; gefährlicher können sich aber die Knochenmarksdepression sowie -- bei einzelnen Substanzen -- Herz- , Leber- oder Nierenveränderungen auswirken. Die Kombination von Cyclophosphamid, Methotrexat und Fluorouracil (CMF) mit oder ohne Prednison, welche während Jahren als Standard galt, verursacht beispielsweise mehr unerwünschte Wirkungen als eine ähnliche Kombination, die statt Cyclophosphamid Chlorambucil (Leukeran ®) enthält (LMF).(16) Kombinationen mit Doxorubicin, z.B. Doxorubicin/Cyclophosphamid, gelten als «aggressiver » und verursachen mehr unerwünschte Wirkungen als z.B. CMF. Einzelne Onkologen setzen Doxorubicin-Kombinationen primär nur bei Patientinnen mit ungünstiger Prognose (rezeptornegativen Tumoren, viszeralen Metastasen) ein; andere halten sie generell als Zweittherapien in Reserve.
Die Modalitäten der Zytostatika-Verabreichung (oral oder intravenös; Therapiedauer; Überwachung hämatologischer und anderer Laborwerte) müssen für jede Chemotherapie- Kombination sorgfältig festgelegt werden. Besonders ist zu beachten, dass die gewählten Medikamente in adäquater Dosierung verabreicht werden. Die Patientin soll durch die Wahl geeigneter Zytostatika, nicht durch Unterdosierung der verwendeten Substanzen, vor unerwünschten Wirkungen geschützt werden.(9)
Therapiewahl
Ob primär eine Hormon- oder eine Chemotherapie eingesetzt werden soll, muss im Einzelfall durch einen erfahrenen Therapeuten sorgfältig abgewogen werden. In Tabelle 5 sind die dabei zu berücksichtigenden Überlegungen schematisch zusammengefasst.
Literatur
- 1) Consensus Conference: J. Am. Med. Ass. (JAMA) 254: 3461, 1985
- 2) I.C. Henderson: Curr. Probl. Cancer 11: 125, 1987
- 3) Editorial: Lancet 2: 1205, 1984
- 4) B. Fisher et al.: N. Engl. J. Med. 320: 473, 1989
- 5) E.G. Mansour et al.: N. Engl. J. Med. 320: 485, 1989
- 6) The Ludwig Breast Cancer Study Group: N. Engl. J. Med. 320: 491, 1989
- 7) B. Fisher et al.: N. Engl. J. Med. 320: 479, 1989
- 8) W.L. McGuire: N. Engl. J. Med. 320: 525, 1989
- 9) K.W. Brunner: Schweiz. Med. Wschr. 117: 688, 1987
- 10) H.J. Senn: Therapiewoche Schweiz 5: 21, 1989
- 11) R. Suart-Harris et al.: Lancet 2: 604, 1984
- 12) K. Höffken et al.: Dtsch. Med. Wschr. 110: 1799, 1985
- 13) G.N. Brodie und A. Elefanty: Drugs 35: 584, 1988
- 14) I.C. Henderson und G.P. Canellos: N. Engl. J. Med. 302: 17 und 78, 1980
- 15) R.G. Cooper: Proc. Am. Ass. Cancer Res. 10: 15, 1969
- 16) F. Cavalli et al.: Schweiz. Med. Wschr. 112: 774, 1982
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK613
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.